Голографическая вселенная, Тертышный Георгий Георгиевич
Физик Тертышный Георгий Георгиевич – – канд. техн. наук, кавалер Почетного знака РДА.

В 2000 -2001 г.г. Клуб «Диа-Элит» при Российской Диабетической Ассоциации (РДА) организовал по плану Президента РДА М. Богомолова проведение первых успешных экспериментов по дистантной трансплантации ткани здоровой поджелудочной железы на крыс с экспериментальным сахарным диабетом. У группы крыс вызывался сахарный диабет. В другом месте вскрывались здоровые новорожденные крысята, извлекалась ткань поджелудочной железы. Затем при помощи специального лазера и широкополосного радиополя, формируемого в устройстве называемом локализатор фотонов, информация со здоровой ткани передавалась на больных крыс. У больных крыс наблюдалось достоверное снижение уровней сахара крови и увеличение выживаемости по сравнению с контрольной группой. Потом эти эксперименты были успешно воспроизведены во многих странах мира.
В ноябре 2011 года разработчику соответствующей аппаратуры физику Тертышному Геогию Георгиевичу было присвоено звание «Кавалер почетного знака «Вместе мы сильнее!».
Патенты
№2005104490
Устройство и способ мультилучевой лазерной спектроскопии
Тип документа:заявка
Авторы: Тертышный Георгий Георгиевич №RU), Чучалин Александр Григорьевич №RU), Маевский Евгений Ильич №RU), Учитель Михаил Львович №RU), О Хан До №RU)
Патентообладатель/заявитель: Заявитель(и): Тертышный Георгий Георгиевич №RU), Чучалин Александр Григорьевич №RU), Маевский Евгений Ильич №RU), Учитель Михаил Львович №RU), О Хан До №RU)
МПК: G01N21/63
Дата публикации: 10.08.2006
НЕИНВАЗИВНЫЙ ПЕРЕНОС ЧАСТОТНО-АМПЛИТУДНОЙ СОСТАВЛЯЮЩЕЙ ЭЛЕКТРОМАГНИТНОГО ПОЛЯ БАКТЕРИЙ С ЦЕЛЬЮ КОРРЕКЦИИ ИХ ФУНКЦИОНИРОВАНИЯ
В.Л. Эвентов1, Г.Г. Тертышный2, М.Ю. Андрианова
Российский научный центр хирургии им. академика Б.В. Петровского РАМН,
Институт проблем управления РАН им. В.А. Трапезникова
NONINVASIVE TRANSFER OF PULSE-AMPLITUDE COMPONENT OF BACTERIA ELECTROMAGNETIC FIELD FOR CORRECTION OF THEIR FUNCTIONING
B.L. Eventov, G.G. Tertyshnyy, M.Yu. Andrianova
Бактерии, помимо материальной клеточной структуры, имеют индивидуальную полевую структуру. Эта структура формирует и определяет цикл функционирования бактерий. Показано, что 41–43% устойчивых к ванкомицину бактерий штамма Enterococcus hirae АТСС 51575 приобрели чувствительность к ванкомицину и погибли после лазерного облучения их полевой структурой штамма чувствительных к ванкомицину бактерий Enterococcus hirae АТСС 10541. В то же время, лазерное облучение устойчивых к ванкомицину бактерий штамма Enterococcus hirae АТСС 51575 без донора не привело к их гибели, также как и в контрольной группе.
Besides material cellular structure bacteria have individual field structure. This structure forms and defines a cycle of bacteria functioning. It was shown that 41-43% steady to vancomicin bacteria (strain Enterococcus hirae АТСС 51575) had got sensitivity to vancomicin and died after laser irradiation with field structure of sensitive to vancomicin bacteria (strain Enterococcus hirae АТСС 10541). At the same time laser irradiation of steady to vancomicin bacteria (strain Enterococcus hirae АТСС 51575) without donor hadn’t led to their destruction, also as well as in control group.
Ключевые слова: волновая структура, перенос, бактерии, лазер.
Keywords: genetic information, noninvasive transfer, bacteria, laser.
ВВЕДЕНИЕ
Бактерии, помимо материальной клеточной структуры, имеют индивидуальную полевую структуру [1, 2, 3, 4,]. Эта структура формирует и определяет цикл функционирования бактерий. При экзогенном полевом воздействии возможно изменение функционирования бактерий. Для эффективного воздействия на конкретный вид бактерий электромагнитное поле внешнего воздействия должно быть по большинству параметров аналогичным собственному полю бактерий Цель исследования: используя лазерный сканер, оценить передачу чувствительности к ванкомицину от штамма Enterococcus hirae (АТСС 10541), чувствительного к ванкомицину, на штамм Enterococcus hirae (АТСС 51575), устойчивый к ванкомицину; подтвердить, что выявленные изменения в устойчивом к ванкомицину штамме требуют присутствия в лазерной аппаратуре донора (штамма Enterococcus hirae АТСС 10541, чувствительного к ванкомицину).
МАТЕРИАЛЫ И МЕТОДЫ
Для считывания и переноса полевой структуры бактерий использовали двухмодовой гелио-неоновый лазерный сканер Т3. Лазерный луч, проходя через электромагнитное поле бактерий, модулируется его полевой структурой. Эта модуляция выражается в изменении частотно-амплитудной характеристики лазерного луча. Модулированный частотно-амплитудной составляющей поля бактерий, лазерный луч попадает на аналогичные бактерии, где детектируется, частично видоизменяя
их полевую структуру и функционирование. В качестве рецепиента использовали Enterococcus hirae АТСС 51575 (устойчивый к ванкомицину штамм), в качестве донора – Enterococcus hirae АТСС 10541 (чувствительный к ванкомицину штамм).
ПОДГОТОВКА КУЛЬТУР МИКРООРГАНИЗМОВ
Предварительно оба штамма бактерий тестировали для подтверждения их устойчивости/чувствительности к ванкомицину. Для этого культуры клеток наносили полосками на чашки Петри с питательной средой (агар) и помещали на поверхность агара диски с ванкомицином (5 мкг). Затем чашки Петри помещали в термостат на 24–48 часов при температуре 30–35° С и анализировали зоны подавления роста микроорганизмов. На чашках Петри с чувствительным штаммом образовывалась чистая зона подавления роста (~3,8 мм от диска), на чашках Петри с устойчивым штаммом образовывалась мутная зона подавления роста (~0,8 мм от диска), что подтверждало фенотип микроорганизмов.
ЭКСПЕРИМЕНТ
Чувствительный к ванкомицину штамм Enterococcus hirae АТСС 10541 осаждали центрифугированием при 1500 об./мин., затем удаляли супернатант, помещали осадок на стеклянное покровное стекло и накрывали сверху вторым стеклянным покровным стеклом. Пакет из двух стекол с осадком чувствительного к ванкомицину штамма Enterococcus hirae АТСС 10541 использовали в качестве донора в лазерной аппаратуре. Реципиент (устойчивый к ванкомицину штамм Enterococcus hirae АТСС) 51575 наносили на 6 чашек Петри с агаром по 1 капле диаметром от 2 до 3 мм. В 2 чашках Петри (1 и 1а) реципиента обрабатывали лазерным лучом, прошедшим через покровные стекла с донором (рис. 1); в 2 чашках Петри (2 и 2а) реципиента обрабатывали лазерным лучом, прошедшим через пустые покровные стекла. Еще 2 чашки Петри с культурой реципиента (3 и 3а) изолировали в экранируемом металлом боксе в отдельной комнате и использовали в качестве контроля, не подвергшегося воздействию лазера. Сразу после эксперимента из каждой чашки Петри отбирали порции обработанных клеток культуры реципиента, которые помещали во флаконы с 8 мл питательной среды (бульон), и пробы инкубировали в термостате ночь при температуре 30–35° С. Каждый флакон с бульоном маркировали соответствующим кодом чашки.
РЕЗУЛЬТАТЫ
В контрольных образцах (2, 2а, 3 и 3а) средняя концентрация клеток через 4 часа составляла 9,38 . 108 клеток/мл, тогда как в образцах, подвергнутых воздействию модулированного Enterococcus hirae АТСС 10541 (1, 1а) (чувствительного к ванкомицину штамма) лазерного луча средняя концентрация клеток составила 4,127 . 108 клеток/мл. Разница концентраций клеток составила 44%, что убедительно доказывает влияние перенесенных свойств чувствительного к ванкомицину штамма бактерий на нечувствительные.
ТУРБИДИМЕТРИЧЕСКИЙ АНАЛИЗ
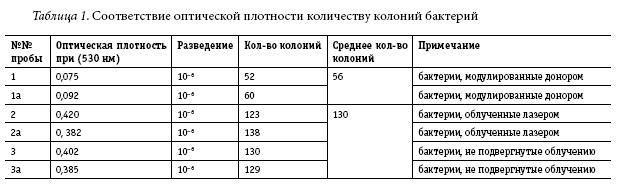
С целью проверки полученных данных, метод агаровых чашек был адаптирован для определения соответствия плотности клеток оптической плотности при 530 нм. Культуры клеток, у которых спектральная поглощательная способность составляла 0,075 / 0,092(1 и 1а) и от 0,382 до 0,420 (2, 2а, 3, 3а), разводили бульоном до степени 10–6. По 1 мл каждого разведения смешивали с трипсиновым соевым агаром, высушивали, инкубировали 48–72 часа при 30–35° С и считывали количество колоний. Раствор ванкомицин-HCl готовили из эталона ванкомицин-HCl, United States Pharmacopeia (USP), содержащего 100 мкг/флакон, разводя его 10 мл стерильной очищенной воды, что давало конечную концентрацию 10,050 мкг/мл. Этот раствор разводили стерильной очищенной водой до концентрации 1 мкг/мл в день исследования.Используя спектрофотометр, каждую культуру в бульоне стандартизировали по плотности клеток. В опытных и контрольных образцах в пробирки, содержащие 9 мл бульона и 1 мл раствора ванкомицин-HCl (10 мкг/мл), вносили по 0,25 мл соответствующих стандартизированных культур микроорганизмов реципиента и инкубировали в водяной бане 4 часа при 37° С. Результаты представлены в табл. 1. Таким образом, было подтверждено, что 43% (р < 0,001) устойчивых к ванкомицину бактерий штамма Enterococcus hirae АТСС 51575 (1 и 1а) приобрело чувствительность к ванкомицину и погибло после лазерного облучения их полевой структурой штамма чувствительных к ванкомицину бактерий Enterococcus hirae АТСС 10541. В то же время, лазерное облучение устойчивых к ванкомицину бактерий штамма Enterococcus hirae АТСС 51575 (2 и 2а) без донора не привело к их гибели, как и в контрольном исследовании (3 и 3а).
ВЫВОДЫ
1. Сканированная лазером сканером T3 со штамма чувствительных к ванкомицину бактерий Enterococcus hirae АТСС 10541 частотно-амплитудная составляющая их полевой структуры привела к гибели 43% устойчивых к ванкомицину бактерий штамма Enterococcus hirae АТСС 51575.
2. Лазерное облучение без донора устойчивых к ванкомицину бактерий штамма Enterococcus hirae АТСС 51575 не приводило к их гибели.
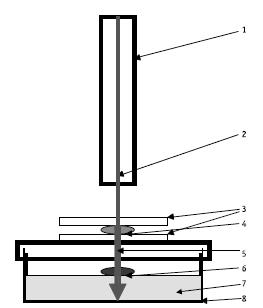
Рис. 1. Схема работы лазерного сканера. 1 – лазер, 2 – лазерный луч, 3 – покровные стекла, 4 – донор – чувствительный к ванкомицину штамм бактерий Enterococcus hirae АТСС 10541. 5 – лазерный луч, модулированный частотно-амплитудной составляющей поля бактерий штамма Enterococcus hirae АТСС 10541 чувствительных к ванкомицину, 6 – реципиент устойчивый
к ванкомицину штамм бактерий Enterococcus hirae АТСС 51575,7 – агар, 8 – чашка Петри
ЛИТЕРАТУРА
1. Будаговский А.В. Дистанционное межклеточное взаимодействие. М.: НПЛЦ «Техника», 2004. 103 с.
2. Недбай В.В., Тертышный Г.Г., Эвентов В.Л., Зеленков С.М. Способ коррекции функционирования клеток организма // Патент Украины № 48946, 12.04.2010.
3. Тертышный Г.Г., Гаряев П.П. Волновые генетические нанотехнологии управления биосистемами. Теория и эксперименты // Новые медицинские технологии. 2007. № 7. С. 49–64.
4. Эвентов В.Л.,Тертышный Г.Г., Жидков И.Л., Ситниченко Н.В., Андрианова М.Ю. Волновая коррекция функционирования клеток организма // Вестник Российской академии естественных наук. 2011, №1. Т. 11. С 22–25. Эвентов Виктор Львович, д.т.н., главный научный сотрудник Российского научного центра хирургии им. акад. Б.В. Петровского РАМН, 119991, г. Москва, Абрикосовский пер., д. 2,тел.: +7 (916) 847-13-50, е-mail: [email protected] Этот адрес электронной почты защищен от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Тертышный Георгий Георгиевич, к.т.н., старший научный сотрудник Института проблем управления РАН им. В.А. Трапезникова,
117997, г. Москва, ул. Профсоюзная, д. 65, тел.: +7 (495)334-89-10
Андрианова Мария Юрьевна, к.м.н., ведущий научный сотрудник Российского научного центра хирургии им. акад. Б.В. Петровского
РАМН,119991, г. Москва, Абрикосовский пер., д. 2

Комментариев нет