Повторение Экспериментов Гаряева П.П. (Кокая)
ВЛИЯНИЕ НИЗКОИНТЕНСИВНОГО ЭЛЕКТРОМАГНИТНОГО ИЗЛУЧЕНИЯ НА ТЕЧЕНИЕ ОСТРОЙ ИНСУЛИНОВОЙ НЕДОСТАТОЧНОСТИ У КРЫС
Кокая Николай Григорьевич
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук.
Нижний Новгород – 2012
Работа выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Нижегородская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Научный руководитель: доктор биологических наук, профессор
Мухина Ирина Васильевна
Официальные оппоненты: доктор медицинских наук, профессор
Потемина Татьяна Евгеньевна
(ГБОУ ВПО «НижГМА» Минздравсоцразвития России,
г. Нижний Новгород) доктор медицинских наук, профессор
Перетягин Сергей Петрович
(ФГУ «ННИИТО», Минздравсоцразвития России,
г. Нижний Новгород)
Ведущая организация: ФГВОУ ВПО «Военно-медицинская Академия им. С.М. Кирова» Министерства обороны Российской Федерации (г. Санкт-Петербург)
Защита диссертации состоится «_____» ____________ 2012 года в _____ часов на заседании диссертационного совета Д 208.061.03 при Нижегородской государственной медицинской академии Министерства здравоохранения и социального развития Российской Федерации по адресу: 603005, г. Нижний Новгород, пл. Минина, д. 10/1.
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО «Нижегородская государственная медицинская академия» Минздравсоцразвития России (603104, г. Нижний Новгород, ул. Медицинская, д. 3а).
Автореферат разослан « _____ » _____________ 2012 г.
Ученый секретарь
диссертационного совета
доктор медицинских наук, профессор Е.А. Дурново
Актуальность исследования.
За последние годы значительно возросло внимание к проблеме биологического действия электромагнитных полей и излучений, сравнимых по интенсивности с естественным электромагнитным фоном. Этот интерес связан в первую очередь с тем, что малое по величине воздействие вызывает биологические эффекты, сопоставимые, или даже более значительные, чем эффекты, наблюдаемые при действии существенно более высоких доз [А.В. Корнаухов, 2003; В.Н. Бинги, 2005; Д.А. Черенков, 2006]. Проблема изучения механизмов сверхслабых воздействий на биологические системы тесно перекликается с проблемой передачи биологической информации, её записью и хранением в клетках, а так же в межклеточном пространстве и между организмами [Е.Б. Бурлакова, 1990; Р. Pomeranz, 1998]. Несмотря на многолетние исследования, механизмы сверхслабых воздействий на биологические системы остаются плохо изученными [В.Н.Бинги, 2005]. В то же время, на основании многочисленных экспериментальных данных, некоторые авторы [Е.Л. Мальцева, Е.П. Пальмина, 1998] склонны считать, что именно электромагнитные взаимодействия внутри и вне биосистемы оказывают важную регулирующую роль в управлении физиологическими функциями наряду с нейрогормональными, гуморальными и биофизическими факторами.
Большое число работ посвящено использованию низкоинтенсивных электромагнитных излучений в терапии заболеваний, резистентных к фармакологическим средствам и невосприимчивых к большинству известных методов лечения [И.А. Мыскина, 2004; Е.В. Суркова, 2005; С.А. Догадин, 2007]. Одним из таких заболеваний, которое трудно поддается терапии, является сахарный диабет. Постоянно увеличивающаяся распространенность и заболеваемость сахарным диабетом позволила экспертам ВОЗ признать наличие эпидемии сахарного диабета неинфекционного характера [М.И. Балаболкин, Е.М. Клебанова, 2007]. Сложный патогенез сахарного диабета, большое число тяжелых осложнений, трудности лечения делают проблему терапии сахарного диабета ещё более актуальной. В настоящее время основными элементами лечения сахарного диабета остается диета, инсулинотерапия и применение пероральных противодиабетических препаратов. Физические методы воздействия применяются главным образом для профилактики и лечения осложнений, связанных с сахарным диабетом [А.Ю. Кехоева, К.В. Агаджанова, И.О.Елизарова, 2010]. На сегодняшний день встречаются единичные указания на то, что низкоинтенсивное лазерное излучение могло бы быть использовано как основной патогенетически обусловленный метод лечения сахарного диабета [О.А. Лукина, 2009].
В экспериментальной медицине модель аллоксанового сахарного диабета получила широкое распространение, так как аллоксан избирательно повреждает β-клетки панкреатических островков, а применение токсических доз аллоксана быстро вызывает у крыс развитие острой инсулиновой недостаточности, сопряженной с токсическим повреждением клеток жизненно важных органов [Р. Досон, Д.Эллиот,1991]. Данная экспериментальная модель очень удобна для изучения патогенетических механизмов, связанных с нарушением углеводного обмена, и позволяет быстро оценить различные способы коррекции [Н.Н. Карнищенко, 2004].
Цель исследования.
Изучить патофизиологические механизмыдействия низкоинтенсивного электромагнитного излучения, преобразованного биоструктурами, в условиях экспериментальной модели острой инсулиновой недостаточности у крыс.
Задачи исследования.
1. Разработать способ воздействия низкоинтенсивным электромагнитным излучением, преобразованным биоструктурами (пЭМИ), на крыс с острой инсулиновой недостаточностью, вызванной введением токсических доз аллоксана.
2. Изучить влияние корригирующего воздействия низкоинтенсивным электромагнитным излучением, преобразованного биоструктурами, на течение острой инсулиновой недостаточности у крыс, вызванной введением токсических доз аллоксана.
3. Исследовать влияние корригирующего воздействия низкоинтенсивным электромагнитным излучением, преобразованным биоструктурами, на биохимические показатели сыворотки крови, морфо-функциональное состояние поджелудочной железы и печени у крыс с острой инсулиновой недостаточностью.
4. Изучить влияние превентивного воздействия низкоинтенсивным электромагнитным излучением, преобразованным биоструктурами, на течение острой инсулиновой недостаточности у крыс, вызванной введением токсических доз аллоксана.
5. Исследовать влияние превентивного воздействия низкоинтенсивным электромагнитным излучением, преобразованным биоструктурами, на биохимические показатели сыворотки крови, морфо-функциональное состояние поджелудочной железы и печени у крыс с острой инсулиновой недостаточностью.
Научная новизна.
В результате проведенных исследований впервые разработан способ воздействия низкоинтенсивным электромагнитным излучением, преобразованным биоструктурами, на крыс с острой инсулиновой недостаточностью.
Впервые установлено, что предложенный способ способствует снижению летальности и нормализации уровня глюкозы в крови у крыс с экспериментальным сахарным диабетом при корригирующем воздействии и повышению устойчивости животных к повреждающему агенту при превентивном применении.
Впервые показано, что корригирующее воздействие данным видом излучения способствует активации регенерационных процессов в ткани поджелудочной железы наряду с имеющимися деструктивными процессами, а превентивное воздействие оказывает цитопротекторное действие и способствует развитию гипертрофических и гиперпластических процессов в ткани поджелудочной железы.
Впервые выявлено снижение активности панкреатической амилазы и печеночных ферментов у крыс с экспериментальным сахарным диабетом в результате воздействия на них низкоинтенсивным электромагнитным излучением, преобразованным биоструктурами.
Впервые изучены патогенетические механизмы компенсаторно-приспособительного и протекторного действия низкоинтенсивного электромагнитного излучения, преобразованного биоструктурами, на модели острой инсулиновой недостаточности у крыс.
Теоретическая и практическая значимость работы.
Полученные экспериментальные данные расширяют современные представления о биологической роли низкоинтенсивных электромагнитных полей, преобразованных биоструктурами, и их значения в регуляции жизнедеятельности организма.
Совокупность полученных данных и теоретических положений позволяет оценить влияние низкоинтенсивного электромагнитного излучения, преобразованного биоструктурами, на течение экспериментального сахарного диабета и патофизиологически обосновать механизмы действия данного вида излучения на биологические объекты.
Основные положения, выносимые на защиту:
1. Корригирующее воздействие низкоинтенсивным электромагнитным излучением, преобразованное биоструктурами, способствует активации компенсаторно-приспособительных механизмов, направленных на сохранение жизнедеятельности организма, и активации регенерационных процессов в поврежденном органе у крыс с острой инсулиновой недостаточностью.
2. Превентивное воздействие низкоинтенсивным электромагнитным излучением, преобразованное биоструктурами, оказывает цитопротекторный эффект, обеспечивая устойчивость животных к действию повреждающего агента.
Внедрение результатов исследования.
Результаты исследования внедрены в научно-исследовательскую работу ЦНИЛ НИИ ПФМ ГБОУ ВПО НижГМА Минздравсоцразвития России для дальнейшего изучения патофизиологических механизмов сверхслабых воздействий на биологические системы и механизмов, связанных с нарушением углеводного обмена.
Апробация диссертации.
Материалы диссертации доложены на школе молодых исследователей «Фундаментальные науки и прогресс клинической медицины» (Москва, 2010), итоговой научной конференции «Татьянин день» (Москва, 2010), 4-ой международной научной конференции молодых ученых медиков (Курск, 2010), 2-ой международной конференции «Фундаментальные и прикладные аспекты медицинской приматологии» (Сочи, 2011),конференции «Психотроника» (Кентукки, США, 2010).
Диссертация апробирована на межкафедральном заседании кафедр нормальной анатомии, патологической физиологии, нормальной физиологии и ЦНИЛ НИИ ПФМ ГБОУ ВПО НижГМА Минздравсоцразвития России 20 января 2012 (протокол №5) (Н. Новгород, 2012).
Личный вклад автора заключался в том, что участвовал в постановке и проведении патофизиологических экспериментов, статистически обрабатывал полученные данные, а также участвовал в написании научных статей.
Публикации.
По теме диссертации опубликовано 10 научных работ, из них 5 – в журналах, рекомендованных ВАК.
Объем и структура диссертации.
Диссертация изложена на 145 страницах машинописного текста и состоит из введения, обзора литературы, трех глав собственных наблюдений, обсуждения полученных результатов, выводов и практических рекомендаций. Работа иллюстрирована 5 таблицами и 27 рисунками. Библиографический указатель включает 230 источников литературы, из них 107 отечественных и 123 зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Для решения поставленных в работе целей и задач эксперименты были выполнены на 140 белых лабораторных крысах-самцах линии Wistar в возрасте 5-6 месяцев, массой 180-220 г. Общее количество объектов исследования и распределение по экспериментальным группам представлено в таблице (Табл.1).
Экспериментальный сахарный диабет вызывали путем внутрибрюшинного введения раствора аллоксана, приготовленного extempore в дозе 200 мг/кг, после 24 часового голодания на фоне нормальных показателей уровня глюкозы в крови.
Экспериментальных животных помещали под наблюдение в стандартные условия вивария. Ежедневно в течение 1,5 месяцев оценивали общее состояние животных, количество потребляемой жидкости, фиксировали день гибели животных во всех наблюдаемых группах, регистрировали уровень глюкозы в крови глюкометром AscensiaEntrust фирмы Bayer.
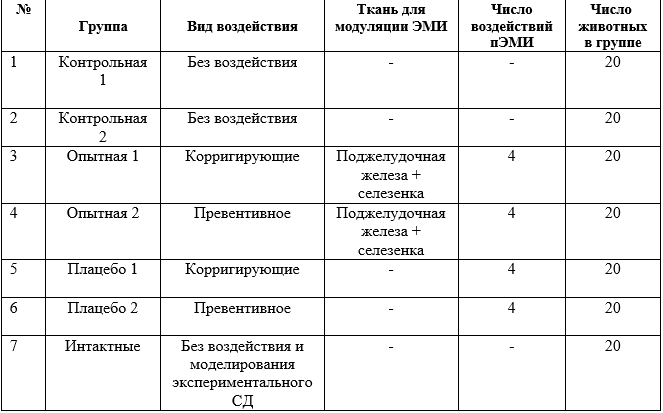
Общее количество объектов исследования и распределение их по группам
В контрольных и плацебо группах забор крови из подъязычной вены для биохимического исследования и изъятие тканей поджелудочной железы и печени для патоморфологического исследования проводили на 3 и 4-е сутки с момента введения аллоксана, что соответствовало дню максимальной гибели животных в этих группах. У интактных крыс и в 1-ой и 2-ой опытных группах забор крови для биохимического исследования осуществляли на 3-е сутки, 8-е сутки эксперимента и через 1,5 месяца с момента введения аллоксана. Изъятие тканей поджелудочной железы для патоморфологического исследования в опытных группах проводили на 8-е сутки и через 1,5 месяца с момента введения аллоксана. Изъятие ткани печени для патоморфологического исследования проводили через 1,5 месяца с момента введения аллоксна.
Содержание уровня глюкозы, общего белка, альбумина, щелочной фосфатазы, АсАТ, АлАТ, амилазы панкреатической, креатинина и мочевины в сыворотке крови экспериментальных животных определяли с помощью биохимического анализатора АБ-02 Уральского оптико-механического завода при длине волны 500/600 нм (режим измерения по конечной точке) и набора специальных реагентов после центрифугирования в течение 10 минут.
Для гистологических исследований ткани фиксировали в 10% нейтральном формалине, обезвоживали в спиртах восходящей концентрации и заливали в парафин. Парафиновые срезы толщиной 5-7 мкм получали на микротоме LeicaSM 2000R, окрашивали гематоксилином и эозином и анализировали с помощью микроскопа LeicaDMLS. Видеоизображения получали на видеосистеме с помощью CCD-камеры.
Полученные данные были обработаны на персональном компьютере с использованием пакета прикладных программ MicrosoftExcel и программы STATISTICA® for Windows, Release 6.0 (2006). Для определения достоверности данных были применены: при количественных нормально распределенных данных – критерий Стьюдента, для непараметрических данных – точный критерий Фишера, непараметрические методы Манна-Уитни. За критерий достоверности была принята величина p<0,05.
Способ воздействия низкоинтенсивным электромагнитным излучением, преобразованным биоструктурами
В качестве источника электромагнитного излучения был использован гелий-неоновый лазер мощностью 2 мВт и длиной волны 632.8 нм, который имеет две одночастотные, совмещенные, ортогональные линейно поляризованные моды излучения [Г.Г. Тертышный, 1999]. Генерацию электромагнитного излучения проводили по схеме интерферометра Фабри-Перо, в которой рабочий лазерный луч многократно проходит через тонкие слои: покровное стекло, слой клеток свежепрепарированных тканей поджелудочной железы или селезенки здорового новорожденного крысенка линии Wistar (Р2-4), предметное стекло. Перед проведением эксперимента изъятые органы (поджелудочная железа, селезенка) в объеме 3 мм3 наносили на предметное стекло, накрывали покровным стеклом и помещали на оптической оси лазерного луча. Юстировку стекол с препаратами проводили таким образом, чтобы обеспечить частичное обратное отражение луча, модулированного препаратами, в резонатор лазера. Такой многопроходный режим позволяет препарату выступать в роли оптического коррелятора [Мазур, Грачев, 1985] и влиять на распределение вторичных мод излучения лазера. Оптические сигналы регистрировались и подавались на электронную схему, которая управляет режимом генерации лазера, при этом происходит частотная стабилизация когерентного излучения. В таком режиме работы импульсный блок питания лазера, играющий роль передатчика электромагнитного излучения, генерирует преобразованное зондируемыми препаратами электромагнитное излучение. Расстояние от зондируемого препарата до активного элемента лазера 11см.
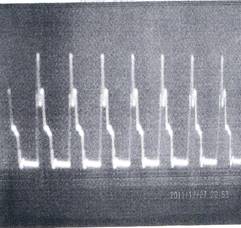
На рисунке 1 представлены зарегистрированные сигналы электромагнитного излучения He-Ne лазера в состоянии резонанса.
A 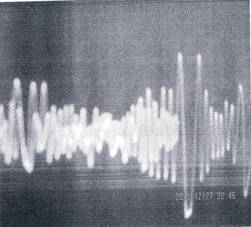
B
Рис.1. Сигнал с блока питания лазера в резонансном режиме без биообъекта (а) и спектр частотно-амплитудных и фазовых составляющих электромагнитного излучения сканируемой ткани поджелудочной железы (б).
Для исключения побочного влияния внешних факторов воздействия для каждой опытной группы параллельно формировались контрольная и плацебо группы. В контрольных группах (табл.1) воздействие электромагнитным излучением не проводилось. Животных 1-ой опытной группы (табл.1) подвергали корригирующему воздействию электромагнитным излучением, преобразованным тканями поджелудочной железы и селезенки новорожденной крысы (Р2-4) (пЭМИ) с 3-х суток с момента введения аллоксана. На животных 2-ой опытной группы (табл.1) осуществляли превентивное воздействие пЭМИ, за сутки до моделирования аллоксанового сахарного диабета. Животных 1-ой плацебо группы (табл.1) подвергали воздействию электромагнитным излучением, не преобразованным биоструктурами, начиная с 3-х суток с момента введения аллоксана. Животных 2-ой плацебо группы (табл.1) подвергали воздействию электромагнитным излучением, также не преобразованным биоструктурами, а аллоксановый сахарный диабет моделировали спустя сутки после последнего воздействия. Животных опытных и плацебо групп располагали на расстоянии 70 см от источника электромагнитного излучения. Воздействие пЭМИ на 1 и 2-ю опытные группы проводили ежедневно по 30 минут в течение 4-х дней по схеме: 10 минутное воздействие пЭМИ, полученным в результате прохождения лазерного луча через препарат с тканью поджелудочной железы; 10 минутное воздействие пЭМИ, полученным в результате прохождения лазерного луча через препарат с тканью селезёнки; 10 минутное воздействие пЭМИ, полученным в результате прохождения лазерного луча через препарат с тканью поджелудочной железы. Воздействие не преобразованным биоструктурами электромагнитным излучением на животных 1-ой и 2-ой плацебо групп осуществляли в течение 4-х дней по 30 минут ежедневно. При этом лазерный луч проходил через предметное и покровное стекла, не содержащих биоструктуры.
В группе интактных животных экспериментальный сахарный диабет не моделировали и воздействие электромагнитным излучением не проводили.
Результаты исследований и их обсуждение
Особенности течения экспериментального сахарного диабета, вызванного введением токсических доз аллоксана
В ходе настоящего исследования были установлены различия в течение экспериментального сахарного диабета у животных в контрольных и в опытных группах. Не было установлено различий в течение аллоксанового диабета у животных 1-ой и 2-ой контрольных групп (р=0,8) и у животных 1-ой и 2-ой плацебо групп (р=0,9). Так же не было установлено различий в течении аллоксанового диабета между контрольными и плацебо группами (р=0,6), однако были выявлены существенные различия в течение экспериментального сахарного диабета у животных 1-ой и 2-ой опытных групп (рис. 2) (р=0,03). После введения аллоксана в дозе 200 мг/ кг у крыс в течение 2-3-х дней развивалась острая инсулиновая недостаточность, сопровождающаяся токсическим повреждением ряда жизненно важных органов и систем. Начиная со 2-х суток с момента введения аллоксана, у животных контрольной и плацебо групп отмечалась выраженная гипергликемия, а средний уровень глюкозы в крови составил 25,93±8,16 ммоль/л, что достоверно отличалось (p=0,004) от исходного значения (рис.2).
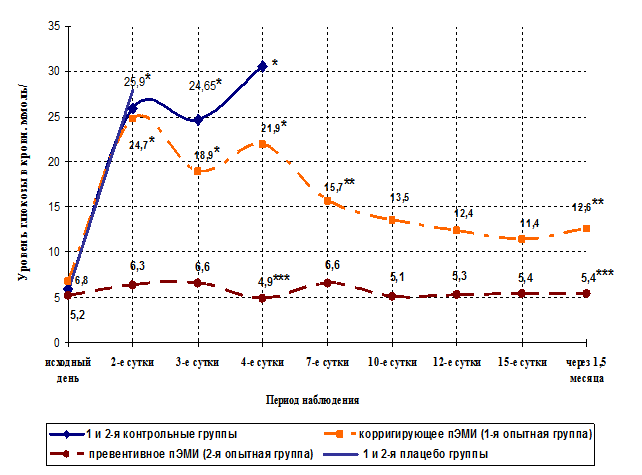
Рис. 2. Динамика уровня глюкозы в крови крыс в экспериментальных группах после моделирования острой инсулиновой недостаточности
* – уровень глюкозы в крови крыс контрольных, плацебо и 1-ой опытной групп на 2-е, 3-е и 4-е сутки после моделирования экспериментального диабета достоверно отличается (p = 0,004) от исходного значения (критерий Фишера);
** – уровень глюкозы в крови крыс 1-ой опытной группы на 7-е сутки и через 1,5 месяца после моделирования экспериментального диабета достоверно отличается (p=0,03) от уровня глюкозы на 2-е и 4-е сутки эксперимента (критерий Фишера);
***- уровень глюкозы в крови крыс 2-ой опытной группы на 4-е, 7-е сутки и через 1,5 месяца после моделирования экспериментального сахарного диабета достоверно отличается (p=0,007) от показателей уровня глюкозы в крови крыс контрольных, плацебо и 1-ой опытной групп (критерий Фишера).
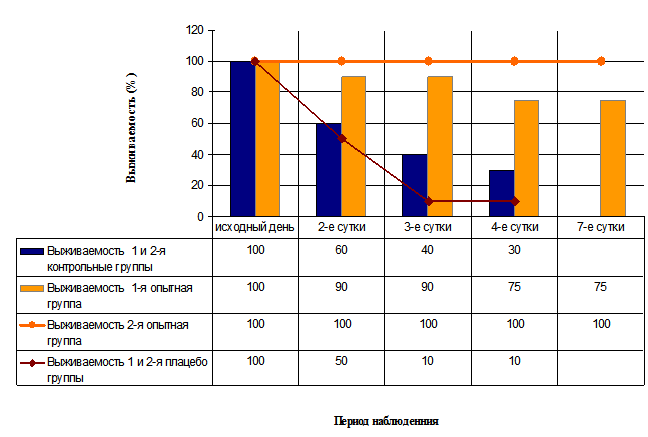
На фоне резкого повышения уровня глюкозы в крови и развития гиперосмолярного состояния в сыворотки крови крыс контрольных и плацебо групп на 3-е сутки с момента введения аллоксана отмечалось достоверное увеличение содержания общего белка (104,0±4,9 г/л) и альбумина (54,2±3,7 г/л) по сравнению с исходными значениями (63,0±2,4 г/л) (р=0,04) и показателями у интактных крыс (63,5±2,8 г/л) (р=0,03), достоверное увеличение показателей ферментативной активности щелочной фосфатазы (126,5±8,3 МЕ/л) (р=0,05), АсАТ (225,8±10,4 МЕ/л) (р=0,02) и креатинина (168,0±6,8 мкмоль/л) (р=0,05), снижение уровня мочевины до 0,7±0,2 ммоль/л. Значения уровня ферментативной активности панкреатической амилазы в сыворотки крови крыс в этих группах увеличились не значительно, что является неблагоприятным прогностическим признаком для жизни при острых панкреатитах. Следует отметить, что в этих группах отсутствовало самопроизвольное снижение уровня глюкозы в крови и нормализация биохимических показателей сыворотки крови за период наблюдения (рис.2). Выживаемость животных в контрольных группах составила 30%, а в плацебо 10% (рис.3).
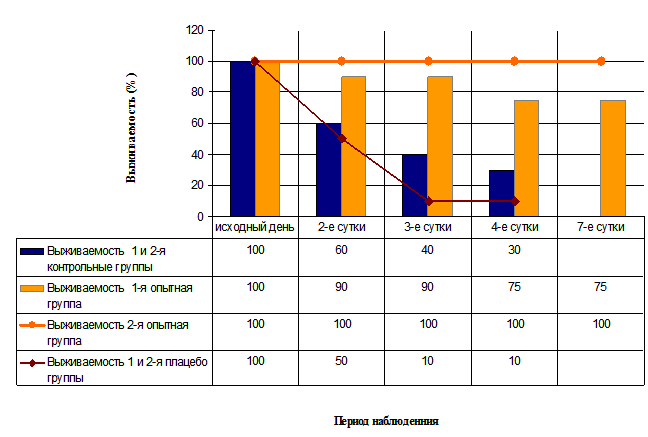
Рис. 3. Выживаемость животных (%) в экспериментальных группах после моделирования острой инсулиновой недостаточности.
Морфологические изменения в ткани поджелудочной железы у крыс в контрольных и плацебо группах были похожи и имели ряд специфических особенностей. В отличие от интактных крыс при гистологическом исследовании поджелудочной железы, у животных этих групп выявлены выраженные дегенеративные изменения островков Лангерганса. Число и размер островков уменьшены, форма их неправильная. Количество β-клеток в островках резко снижено, в большинстве из них отмечалась вакуолизация цитоплазмы, уменьшение размеров ядер, конденсация хроматина, в некоторых клетках – кариопикноз. Выявлено наличие лимфоцитарного инфильтрата вокруг и внутри части островков.
В препаратах печени крыс в этих группах обнаружено сохранение балочного строения клеток, границы гепатоцитов выражены слабо. Ядра средние или крупные с ядрышком. Общее количество клеток не претерпевало значительных изменений по сравнению с интактными, однако, обнаруживались дегенерирующие гепатоциты, в связи с чем, количество нормальных гепатоцитов было меньше. У дегенерирующих гепатоцитов встречались гиперхромные ядра неправильной формы (кариопикноз), у некоторых клеток ядро отсутствовало. У большинства клеток цитоплазма рыхлая с небольшими вакуолями.
Эффект от корригирующего воздействия низкоинтенсивным электромагнитным излучением, преобразованным биоструктурами
На фоне развившейся острой инсулиновой недостаточности на животных 1-ой опытной группы, оказывали корригирующее воздействие низкоинтенсивным ЭМИ He-Ne лазера, преобразованным тканями поджелудочной железы и селезенки новорожденного крысенка (Р 2-4). Средний показатель уровня глюкозы в крови животных 1-ой опытной группы на 4-е сутки с момента введения аллоксана, составил 21,93±9,91 ммоль/л, что достоверно (p=0,02, критерий Фишера) отличалось от исходного значения (5,97±1,38). После воздействия к 7-м суткам с момента введения аллоксана средний показатель уровня глюкозы в крови крыс снизился до 15,75±8,41 ммоль/л (p=0,03, критерий Фишера) (рис.2,4). В большинстве случаев (65%) после воздействия пЭМИ уровень глюкозы в крови крыс 1-ой опытной группы нормализовался, а у 7 животных (35%) в течение всего периода наблюдения (1,5 месяца) отмечалась выраженная гипергликемия. Несмотря на стойкое повышение уровня глюкозы в крови у этих животных, сохраняющееся в течение длительного периода, их гибели не произошло, а общее состояние расценивали как удовлетворительное.
На 3-е сутки эксперимента у крыс в 1-ой опытной группе показатели общего белка, альбумина, креатинина и мочевины в сыворотки крови оставались в пределах нормы, что достоверно отличалось от тех же показателей в контрольных и плацебо группах (р<0,05). На 3-е и 8-е сутки эксперимента в сыворотке крови животных 1-ой опытной группы отмечалось достоверное увеличение, по сравнению с исходными значениями, показателей щелочной фосфатазы (345,3±12,5 МЕ/л; р=0,01), АсАТ (178,5±13,4 МЕ/л; р=0,03) и значительное увеличение панкреатической амилазы (4986,0±145,5 МЕ/л; р=0,002). Через 1,5 месяца после введения аллоксана у выживших животных отмечалось нормализация биохимических показателей в сыворотки крови. Выживаемость животных в 1-ой опытной группе на 4-е сутки с момента введения аллоксана составила 90%, а к 7-м суткам снизилась до 75% и оставалась на этом уровне в течение 1,5 месяцев, что значительно отличается от показателей выживаемости в контрольных (30%) и плацебо (10%) группах (рис.3).
Гистологическая картина препаратов поджелудочной железы в 1-ой опытной группе на 8-е сутки с момента введения аллоксана характеризовалась признаками функционального напряжения работы клеток островков Лангерганса. Наблюдались в основном мелкие и средние островки. Доля инсулярного аппарата была уменьшена, определялась вакуолизация β–клеток, уменьшение их количества. Деструктивные изменения были выражены в различной степени. Особенностью гистологической картины в препаратах этой группы являлось сохранность ядер клеток островковой зоны железы. Этого не наблюдалось в препаратах поджелудочной железы контрольной и плацебо групп. Спустя 1,5 месяца с момента введения аллоксана гистологическая картина поджелудочной железы в 1-ой опытной группе характеризовалась наличием большого количества мелких островков правильной формы, нормальной гистологической структуры вблизи кровеносных синусов и протоков. Наряду с этим наблюдались дегенеративные изменения в разной степени выраженности, участки воспалительных инфильтратов в строме железы и склероз. Подобные структурные изменения в ткани поджелудочной железы говорят не только о перенесенном цитотоксическом воздействии аллоксана на клетки островковой зоны, приводящие к дегенеративным изменениям, но и об активации регенерационных процессов.
В отличие от контрольных и плацебо групп при гистологическом исследовании препаратов печени крыс 1-ой опытной группы в отдаленном периоде (через 1,5 месяца) были выявлены выраженные дегенеративные изменения в структуре органа. Нарушено балочное расположение гепатоцитов. В паренхиме встречалась лимфоцитарная инфильтрация. Большинство центральных вен значительно расширены и часто полнокровны. В портальных трактах сильная гистиолимфоцитарная инфильтрация. Купферовские клетки умеренно активированы, большинство имеет вытянутую форму. Увеличение количества клеток Купфера в печени крыс является показателем напряженного фагоцитоза, что может быть связано с более активной работой печени по утилизации продуктов распада различных клеточных структур. Гепатоциты немного гипертрофированы. Следует отметить, что большинство ядер в клетках правильной формы, хорошо окрашены, с ядрышками. Так же встречались гепатоциты с «дырчатыми» ядрами, клетки без ядер, или с пикнозом ядра. Двуядерных клеток было очень мало.
Эффект от превентивного воздействия низкоинтенсивным электромагнитным излучением, преобразованным биоструктурами
Во 2-ой опытной группе, на животных которой оказывали превентивное воздействие пЭМИ, наблюдали более выраженный эффект, чем в 1-ой опытной группе (рис. 2, 3, 4). В этой группе не было отмечено ни одного случая летального исхода, наблюдалась 100% выживаемость животных в течение всего периода наблюдения (рис.3). У 90% животных 3-ей группы после введения аллоксана уровень глюкозы в крови оставался в пределах физиологической нормы в течение всего периода наблюдения (1,5 месяца), что достоверно отличалось (р=0,03) от значений показателя уровня глюкозы в крови крыс 1-ой опытной группы (рис. 2, 4).
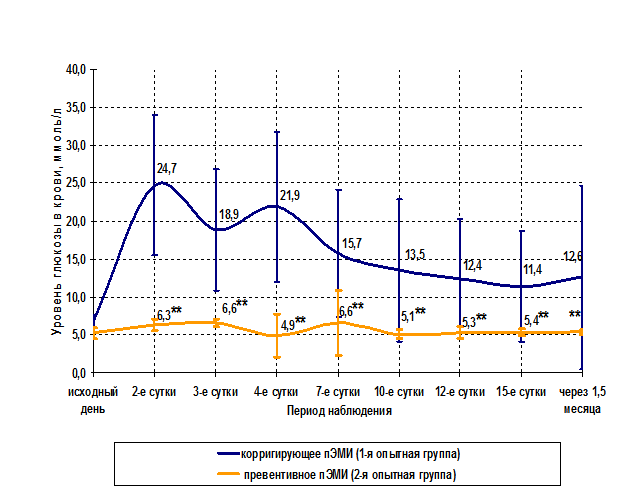
Рис. 4. Динамика уровня глюкозы в крови животных 1-ой и 2-ой опытных групп за период наблюдения, ммоль/л.
** – уровень глюкозы в крови крыс 2-ой опытной группы достоверно отличается (p=0,03) от уровня глюкозы в крови крыс 1-ой опытной группы (критерий Фишера);
За время наблюдения у двух крыс из 2-ой опытной группы к 6-м суткам эксперимента был отмечен подъем уровня глюкозы в крови более 20 ммоль/л с последующим самопроизвольным снижением до нормальных значений. Изменения биохимических показателей в сыворотке крови крыс 2-ой опытной группы, в отличие от крыс в контрольных, плацебо и 1-ой опытной групп, были менее выраженными. Однако на 3-е и 8-е сутки эксперимента было отмечено достоверное увеличение, по сравнению с исходными значениями, ферментативной активности щелочной фосфатазы (123,7±9,8; р=0,04), АсАТ (156,8±23,4; р=0,05) и панкреатической амилазы (1238,8±235,3; р=0,008), что связано с цитотоксическим действием аллоксана. Через 1,5 месяца с момента введения аллоксана у крыс во 2-ой опытной группе наблюдалась нормализация биохимических показателей в сыворотке крови. В течение всего периода наблюдения общее состояние животных 2-ой опытной группы расценивали как удовлетворительное.
Гистологическая картина препаратов поджелудочной железы во 2-ой опытной группе на 8-е сутки с момента введения аллоксана значительно отличалась от 1-ой опытной группы, контрольных и плацебо групп. Наряду с патологической картиной ткани поджелудочной железы и воспалительными изменениями в ней, в препаратах наблюдали большое количество островков как мелких, так и среднего и крупного размеров с просветлённой цитоплазмой, правильной округлой формой, крупными, округлыми ядрами, содержащими ядрышко. Встречались островки по своей структуре близкие к структуре островкового аппарата интактных крыс. Спустя 1,5 месяца с момента введения аллоксана гистологическая картина в этой группе характеризовалась признаками гипертрофии и гиперплазии поджелудочной железы. Наблюдали большое количество островков разного размера, правильной округлой формы. Структура островков и отдельных β-клеток была не изменённой, ядра в клетках большие, округлые с ядрышками.
Пригистологическом исследовании печени во 2-ой опытной группе обнаружили организованную балочную структуру паренхимы печени на большей части площади препарата. Около крупных сосудов умеренное скопление темно-окрашенных клеток лимфоидного типа. Синусоиды умеренно расширены. Цитоплазма большинства гепатоцитов умеренно оксифильная, зернистая с небольшими вакуолями. По сравнению с 1-ой опытной группой отмечено появление нормальных гепатоцитов. Ядро у большей части клеток четкое, хорошо структурированное, хорошо окрашенное с четко различимыми ядрышками. Двуядерные клетки встречались редко.
ЗАКЛЮЧЕНИЕ
Ввиду избирательного цитотоксического действия аллоксана на клетки поджелудочной железы у экспериментальных животных в контрольных и плацебо группах развивалась острая инсулиновая недостаточность, которая, согласно биохимическим показателям, сопровождалась выраженной гипергликемией, гиперосмолярностью, кетоацидозом в сочетании с собственным токсическим действием аллоксана. Не корригируемая инсулиновая недостаточность приводила к гибели животных на 3-4-е сутки с момента введения аллоксана. Несмотря на выраженные дегенеративные изменения в поджелудочной железе значимых изменений в структуре печени обнаружено не было. Гистологическая картина печени в большей степени была характерна для токсического повреждения клеток печени (кетоацидоз, собственное токсическое действие аллоксана), которое представлено дегенерирующими гепатоцитами без разрушения структуры паренхимы печени. Это говорит о том, что ввиду острой не корригируемой инсулиновой недостаточности при применении токсических доз аллоксана животные контрольных и плацебо групп погибали раньше, чем реализовывались компенсаторно-приспособительные механизмы, характерные для длительного хронического течения сахарного диабета, которые имели бы отражение в структурных изменениях заинтересованного органа – печени.
Напротив, у животных 1-ой опытной группы, которые подвергались корригирующему воздействию пЭМИ в остром периоде и выживали после введения токсических доз аллоксана, отдаленная морфологическая картина в поджелудочной железе, наряду с деструктивными изменениями, характеризовалась признаками начинающейся регенерации поврежденного органа, а в печени – выраженными дегенеративными изменениями в структуре органа. Подобные изменения в печени были обусловлены как последствиями острого цитотоксического действия аллоксана, так и воздействием ряда патологических факторов, появляющихся при хроническом течении инсулиновой недостаточности и нарушении углеводного обмена. На первом этапе корригирующее воздействие электромагнитным излучением, преобразованное тканями поджелудочной железы и селезенки новорожденного крысенка, у животных с развившейся острой инсулиновой недостаточностью (1-я опытная группа) стимулировало активацию компенсаторно-приспособительных механизмов, направленных на сохранение жизнедеятельности, о чем говорит высокая выживаемость животных в остром периоде (90%). На втором этапе, учитывая наличие стойкого патологического состояния, у животных начинали реализоваться компенсаторно-приспособительные механизмы, направленные на восстановление утраченной функции и нормализацию углеводного гомеостаза, которые сопровождались выраженными изменениями паренхиматозной структуры заинтересованного органа – печени, и активации процессов регенерации в поджелудочной железе. Об успешной реализации компенсаторно-приспособительных механизмов говорила высокая выживаемость животных в этой группе в течение всего периода наблюдения (75%), положительная динамика уровня глюкозы в крови и биохимических показателей в сыворотке крови (рис. 2, 3, 4).
В отличие от корригирующего воздействия пЭМИ, превентивное воздействие на животных 2-ой опытной группы оказало цитопротекторный эффект на клетки поджелудочной железы, вероятно, за счет повышения резистентности тканей к стрессорным воздействиям. Активация компенсаторно-приспособительных механизмов у крыс, в результате превентивного воздействия пЭМИ, способствовала 100% выживаемости и устойчивости животных к действию аллоксана в остром периоде, а в более поздние сроки привела к гипертрофическими и гиперпластическими изменениям в поджелудочной железе, которые носили компенсаторный характер, сохранении морфологической структуры печени.
ВЫВОДЫ
1. Разработан способ коррекции экспериментальной острой инсулиновой недостаточности у крыс, основанный на воздействии низкоинтенсивным электромагнитным излучением гелий-неонового лазера, преобразованным тканями поджелудочной железы и селезенки новорожденного крысенка.
2. На экспериментальной модели аллоксанового диабета показано, что корригирующее воздействие данным видом излучения приводит к снижению уровня глюкозы в крови до нормальных значений у 65% животных и 75% выживаемости.
3. При корригирующем воздействии низкоинтенсивным электромагнитным излучением, преобразованным биоструктурами, на животных с экспериментальной инсулиновой недостаточностью реализовались компенсаторно-приспособительные механизмы, приводящие к нормализации биохимических показателей сыворотки крови и активации процессов регенерации в ткани поджелудочной железы, но сопровождались дегенеративными изменениями в структуре ткани печени.
4. Установлено, что превентивное воздействие низкоинтенсивным электромагнитным излучением, преобразованное тканями поджелудочной железы и селезенки новорожденной крысы, предотвращает повышение уровня глюкозы в крови и обеспечивает 100% выживаемость животных при последующем введении токсических доз аллоксана.
5. В основе превентивного воздействия данным видом излучения лежит выраженный цитопротекторный эффект на клетки поджелудочной железы, что способствует нормализации биохимических показателей в сыворотке за счет развития гипертрофических и гиперпластических процессов в поврежденном органе и сохранении структуры ткани печени.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
Полученные результаты могут быть использованы для дальнейшего исследования патофизиологических механизмов действия низкоинтенсивных электромагнитных излучений на биологические объекты, как при острой инсулиновой недостаточности, так и при других патологических состояниях организма.
Список научных работ, опубликованных по теме диссертации
1. Влияние модулированного биоструктурами электро- магнитного излучения на течение аллоксанового сахарного диабета у крыс / Гаряев П.П., Кокая А.А., Мухина И.В., Кокая Н.Г. // Бюллетень Экспериментальной Биологии и Медицины №2, 2007, с. 155-158.
2. Влияние превентивного воздействия модулированного био- структурами электромагнитного излучения на морфологические изменения в поджелудочной железе у крыс с экспериментальной инсулиновой недостаточностью / Кокая Н.Г., Кокая А.А., Мухина И.В. // Материалы итоговой научной конференции «Татьянин день». – Москва- 2010.- с. 59.
3. Особенности морфологических изменений в поджелудочной железе у крыс при лечении экспериментальной инсулиновой недостаточности электромагнитным излучением / Кокая Н.Г., Кокая А.А., Мухина И.В. // Материалы к докладу школы молодых исследователей «Фундаментальные науки и прогресс клинической медицины».- Москва- 2010.- с. 88.
4.Влияние корригирующего и превентивного воздействия модулированного биоструктурами электромагнитного излучения на течение экспериментального сахарного диабета у крыс / Кокая Н.Г., Кокая А.А., Мухина И.В. // Тезисы 4-ой Международной научной конференции молодых ученых медиков. – Курск – 2010.- с. 158-161.
5. Эффект от воздействия электромагнитным излучением модулированным тканью поджелудочной железы и селезенки на течение экспериментального сахарного диабета у крыс / Фридман М., Кокая А.А., Кокая Н.Г., Мухина И.В. // Труды конференции «Психотроника»- Кентукки, США- 2010.-с. 22-25.
6. Влияние низкоинтенсивного лазерного излучения на отдаленные структурные перестройки в ткани поджелудочной железы у крыс с острой инсулиновой недостаточностью/ Кокая А.А., Кокая Н.Г., Мухина И.В. //
Тезисы к докладу 2-ой международной конференции «Фундаментальные и прикладные аспекты медицинской приматологии».- Сочи-2011.- с. 293-301.
7. Влияние корригирующего и превентивного воздействия электромагнитным излучением, модулированным биоструктурами, на течение острой инсулиновой недостаточности у крыс / Кокая Н.Г., Кокая А.А., Мухина И.В. // Современные технологии в медицине №3, 2011, с. 11-15.
8.Морфологические изменения в поджелудочной железе крыс при коррекции острой инсулиновой недостаточности электромагнитным излучением, модулированным биоструктурами / Кокая Н.Г., Кокая А.А.,Мухина И.В. // Естественные и технические науки №3(53), 2011, с. 156-164.
9. Влияние модулированного биоструктурами электромагнитного излучения на отдаленные адаптационные структурные перестройки клеток печени у крыс с экспериментальным сахарным диабетом / Кокая Н.Г., Кокая А.А., Мухина И.В. // Вестник новых медицинских технологий №3, 2011, с. 123-126.
10. Отдаленные адаптационные структурные перестройки клеток печени и поджелудочной железы крыс при коррекции острой инсулиновой недостаточности электромагнитным излучением, модулированным биоструктурами / Кокая А.А., Кокая Н.Г., Мухина И.В. // Медицинский альманах №5, 2011, с. 175-179.
Автор выражает сердечную благодарность и глубокую признательность всему коллективу ЦНИЛ НИИ ПФМ НижГМА и особенно сотрудникам отдела морфологии и отдела биохимии, научному руководителю д.б.н, профессору Мухиной И.В. за высокий профессионализм и мудрость учителя, к.м.н. Кокая А.А., а так же Тельных Л.Г. генеральному директору ООО «Октябрьский ССРЗ-НН» за спонсорскую помощь.

Комментариев нет